ANOMALIAS CROMOSSÔMICAS EM ABORTOS ESPONTÂNEOS EM UMA MATERNIDADE PÚBLICA DO MUNICÍPIO DE VITÓRIA, ESPIRITO SANTO, BRASIL.
Resumo
Objetivo: Verificar a frequência de anomalias cromossômicas em material de aborto espontâneo de uma Maternidade pública de Vitória, ES, Brasil. Método: Foi realizada a cultura semidireta de vilosidades coriônicas. Foram coletadas 70 amostras, 24 não apresentaram vilosidades coriônicas e 46 amostras passaram pelo exame citogenético. Resultado: Em 31 amostras o crescimento celular não foi observado, e em 15 foi obtido sucesso. Foram encontrados cinco cariótipos normais e dez anormais, dentre eles trissomias, tetraploidia, monossomia do X, triploidia e monossomia de autossomo.
Conclusão: Neste estudo a frequência de anomalias cromossômicas em material de aborto espontâneo foi elevada comparada a estudos semelhantes na literatura.
Palavras‐Chaves: Aborto Espontâneo; Aberrações Cromossômicas; Citogenética
Introdução
Abortamento é uma síndrome hemorrágica que culmina com morte e/ou expulsão do concepto, antes que este atinja a sua viabilidade.1 Do ponto de vista clínico, aproximadamente 15 a 20% das gestações são espontaneamente interrompidas.2,3 Pode ser espontâneo, quando não há fator precipitante, ou provocado, quando existir ação deliberada para interrupção da gravidez. Pode ser classificado, segundo a idade gestacional, em: precoce, quando se der até a 12ª semana, e tardia, entre a 12ª e 22ª semanas, sendo que na maioria das vezes ocorre nas primeiras 12 semanas de gestação.4
Até a década de 60, a investigação das perdas fetais limitava-se ao estudo clínico e anatomopatológico. O advento da citogenética possibilitou a investigação de possíveis anomalias cromossômicas nesses casos,4 as quais podem ser estruturais (isocromossomos, translocações, inversões, deleções, inserções, duplicações, anel cromossômico) ou numéricas, e envolver um ou mais autossomos, cromossomos sexuais, ou ambos.5 As numéricas geralmente envolvem um cromossomo extra, como por exemplo, a Síndrome de Down, na qual ocorre a trissomia do cromossomo 21 ou a falta de um cromossomo (monossomia), como é o caso da Síndrome de Turner, cujo cariótipo é 45,X.6 Além destes, há outros tipos de alterações numéricas, como a triploidia, tetraploidia, tetrassomias e pentassomias.5
As anomalias cromossômicas estão presentes em aproximadamente 50% dos
abortos espontâneos do primeiro trimestre.1-6 Devido a muitas trissomias autossômicas serem incompatíveis com a vida, muitos embriões são espontaneamente abortados. Muitos fetos com trissomias autossômicas podem até sobreviver, porém têm o desenvolvimento afetado. A Síndrome de Down é a trissomia mais comum compatível com a vida. Já a monossomia de um autossomo é sempre letal resultando em um aborto espontâneo.6 Estudos7-10 demonstram as trissomias como as principais causas dos abortos espontâneos, seguidas de triploidias, monossomia do X, tetraploidias, trissomias duplas e anomalias estruturais, não obrigatoriamente nesta ordem.
A identificação da causa da perda fetal ajuda a estimar os riscos de recorrência em futuras gestações e promover aconselhamento genético para a família. Segundo Horovitz et al,11 (2005), quando excluídas e redistribuídas proporcionalmente as causas mal definidas de mortalidade infantil, as causas perinatais estavam na primeira posição em 1980 no Brasil, responsáveis por 38% dos óbitos em menores de um ano, ocupando as anomalias congênitas a quinta posição, com 5% do total. Em 1990, o perfil começou a mudar, notando-se uma redução proporcional nas causas infecciosas e nutricionais, passando as anomalias congênitas para 8% e quarta causa. No último ano avaliado (2000), as diferenças foram bastante significativas, com grande redução proporcional dos óbitos por causas infecciosas e respiratórias, que passaram para menos de 10%, assumindo as malformações congênitas a segunda posição, como causa de 13% dos óbitos em menores de um ano. Essas estatísticas referentes aos defeitos congênitos e mortalidade infantil no Brasil podem ser classificadas como surpreendentes, considerando sua magnitude e a total ausência de políticas governamentais relacionadas à prevenção e ao manejo desse grupo de problemas.
Diante do número crescente de casos de abortos de repetição e de crianças nascidas com malformações congênitas, esse estudo é importante pois pode contribuir com elaboração e/ou melhoria das políticas públicas nesse tema.
Objetivo
O objetivo deste trabalho é verificar a frequência de anomalias cromossômicas presentes em abortos espontâneos em uma maternidade pública de Vitória, ES, Brasil.
Método
Este é um estudo prospectivo e foi realizado com pacientes submetidas à curetagem pós-aborto, sem causa conhecida, na Maternidade Pro-Matre, localizada no Município de Vitória, ES, no período de abril a outubro de 2007. Foram excluídas do estudo as pacientes que afirmaram ter provocado o aborto. Após receberem todas as informações necessárias sobre a pesquisa, se de acordo, elas assinaram o Termo de Consentimento Livre Esclarecido (TCLE).
Durante a curetagem, os restos ovulares foram coletados em frascos contendo soro fisiológico, sob condições assépticas separando a porção mais sugestiva de âmnio e placenta. A equipe do centro cirúrgico do hospital recebeu todas as informações necessárias para realizar a coleta de forma mais adequada. Os frascos identificados foram encaminhados ao Laboratório, não ultrapassando 48 horas da coleta.
As amostras foram submetidas à cultura semidireta de vilosidade coriônica (cultura de 24 a 48 horas). As vilosidades presentes nos restos ovulares foram separadas em placa de Petri estéril. Todos os procedimentos foram realizados dentro de uma capela de fluxo laminar (Bio Protector VECO®). Depois de separadas, as vilosidades foram colocadas em frascos de cultura previamente identificados e preparados com meio para cultura (AmniomaxTM Gibco® INVITROGEN) utilizando-se 4,2 ml do meio. Os frascos de cultura foram lacrados e levados ao banho-maria a 37ºC, permanecendo por 24h. Após 24h em banho-maria, as culturas foram retiradas e tratadas com Colchicina (SigmaALDRICH®) e novamente submetidas ao banho-maria. Após 45 minutos, o sobrenadante das amostras foi coletado com o auxílio de pipeta Pasteur e 5 ml de solução hipotônica (Citrato de Sódio 0,075M) foram adicionados às culturas, que então retornavam ao banho-maria por mais 30 min a 37ºC. Para a fixação, três banhos de fixador [Metanol (Merck®) e Ácido Acético (Merck®)] na proporção de 3:1 respectivamente foram realizados, com intervalos de 10 minutos. O fixador do último banho não era descartado. Os frascos com as culturas foram conservados em geladeira para a confecção das lâminas no dia seguinte. As lâminas (Precisium®), foram previamente lavadas com sabão neutro e conservadas em álcool 92,8%. Após secagem e identificação com o registro das pacientes, foram colocadas em uma placa aquecida a 60ºC. Para cada paciente, foram feitas em média oito lâminas. As vilosidades foram então retiradas da solução fixadora com pipeta Pasteur e colocadas em placa de Petri de forma dispersa, para posterior adição de 2ml de ácido acético a 60% deixando-se agir por 2 minutos. Após este tempo pingava-se apenas o líquido da placa de Petri, gota a gota sob cada lâmina. As lâminas eram retiradas da placa aquecida somente após secagem completa. As mesmas passaram pelo bandeamento GTG que consistiu num mergulho por 1s em solução de Tripsina (Gibco® INVITROGEN) 1:250, e lavadas em solução Tampão Fosfato. A coloração foi realizada com corante Giemsa a 30%, na qual as lâminas ficaram imersas por 7 minutos e então lavadas com água destilada.12
O crescimento celular foi avaliado em microscópio óptico. Em média foram analisadas de quinze a vinte metáfases por caso, as quais foram desenhadas manualmente e após uma criteriosa avaliação, o diagnóstico foi feito. A ausência de crescimento celular era informada nos resultados da pesquisa. Os laudos foram confeccionados e enviados via Correios para as pacientes. Aquelas que sentiram necessidade compareceram ao Laboratório para uma melhor explicação do diagnóstico.
Esse trabalho foi aprovado pelo CEP da Maternidade Pro-Matre em 23/03/2007.
Resultados
Foram coletadas 70 amostras de restos ovulares, sendo que destas, 24 não
apresentaram vilosidades coriônicas. Das 46 culturas semidiretas realizadas com as amostras que apresentaram vilosidades coriônicas, em 31 (67%) não foi observado crescimento celular. O crescimento celular e a consequente determinação do cariótipo foram possíveis em 33% (15/46) das amostras submetidas ao exame citogenético.
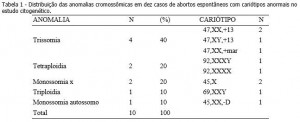
O estudo citogenético mostrou que 66% (10/15) dos casos de aborto espontâneo do primeiro trimestre apresentaram anomalias cromossômicas (tabela 1). Foram encontrados três casos de trissomia do cromossomo 13, compatíveis com Síndrome de Patau e uma trissomia de um cromossomo marcador. Dois casos de tetraploidia foram encontrados, além de dois casos de monossomia do X, compatíveis com Síndrome de Turner e um caso de triploidia. Foi encontrado também um caso de monossomia de um cromossomo autossomo do grupo D, cariótipo 45,XX,-D. Dos cinco casos de cariótipo normal encontrados, quatro foram do sexo masculino (46,XY) e um caso do sexo feminino (46,XX).
Discussão
Desde a década de 70 é tecnicamente possível investigar anormalidades cromossômicas em material de abortamento.4 No entanto, apesar do grande avanço da genética, essa análise ainda é feita em um número reduzido de casos de abortos mesmo em centros mais desenvolvidos. No Brasil há poucos estudos sobre a relação entre abortos espontâneos e anomalias cromossômicas fetais. No Estado do Espírito Santo não há nenhuma evidência de estudos em hospitais da rede pública.
Em nosso estudo, obtivemos sucesso no crescimento celular de 33% das amostras. A literatura sugere que em até 40% das culturas não ocorra crescimento celular, devido à rápida degeneração das vilosidades coriônicas,13 porém, considerando que o presente estudo foi realizado com pacientes de um hospital público, é possível que o aumento neste percentual possa ter sido ocasionado pela demora da gestante na procura do atendimento médico. Assim, o produto da concepção permaneceu retido por um período maior do que aquele em que poderíamos ter encontrado uma quantidade suficiente de células vivas que nos permitiria maior sucesso no crescimento celular e obtenção do diagnóstico citogenético.
As alterações cromossômicas são a causa mais frequente reconhecida de morte fetal na nossa espécie. A sua origem depende de vários fatores, incluindo fatores ambientais e genéticos, além de fatores intrínsecos ao indivíduo.14 As anomalias cromossômicas são classificadas em aneuploidias e euploidias. As aneuploidias ocorrem quando o número de cromossomos a mais não é um múltiplo exato do número haploide, em decorrência da não disjunção ou não separação adequada de um ou mais cromossomos durante a meiose. Como no caso das trissomias, durante a mitose, uma célula divide-se em duas células-filhas, com número diploide de cromossomos. A meiose deve produzir células haploides a partir de células diploides. Na monossomia X (45,X), o X presente é materno em 70 a 80% dos casos, ou seja, nesses casos, o X ou o Y paterno é que foi perdido na meiose ou nos primeiros estágios da embriogênese.15 As euploidias são alterações que envolvem todo o genoma, originando células que contêm um múltiplo exato de 23 cromossomos em seu núcleo, ou seja, um conjunto haploide a mais nas células, além do conjunto normal básico de cromossomos.14,15 As triploidias têm origem materna em aproximadamente 80% dos casos, com a incorporação de um corpúsculo polar no oócito. Menos frequentemente (aproximadamente 20% dos casos), a origem é paterna, pela dispermia, isto é, fertilização de um oócito por dois espermatozoides.15 As tetraploidias geralmente têm origem na primeira divisão mitótica (clivagem) do zigoto, na qual os cromossomos se dividem normalmente, mas não ocorre a citocinese, formando apenas uma célula com 92 cromossomos14 Raríssimos casos foram descritos de fertilização de um oócito normal por três espermatozoides.16,17
Neste trabalho as trissomias foram as anomalias cromossômicas mais comuns e representaram uma taxa de 40% das anomalias encontradas, corroborando com diversos autores,1-4,7-9,10,18 que encontraram de 30 a 50% de trissomias em seus estudos. Dentre elas, encontramos um cariótipo com um cromossomo marcador, 47,XX,+mar. Esse marcador é um cromossomo estruturalmente anormal que não pode ser identificado por técnicas de bandeamento convencionais, como a banda G. De origem desconhecida, ele aparece como um cromossomo adicional no cariótipo, podendo ou não estar presente em todas as células. Após investigações complementares com técnicas de citogenética molecular, como por exemplo Fluorescent in situ hybridization (FISH) e array Comparative Genomic Hybridization (aCGH), é possível descobrir a origem do material adicional.19,20 A técnica de FISH é baseada na formação de um híbrido entre sequências de DNA ou regiões específicas presentes nas células ou em cromossomos de preparações citológicas e sondas de DNA marcadas. O híbrido formado pode ser observado diretamente ao microscópio, após uma marcação com fluorocromos específicos.19 O aCGH é uma técnica que permite investigar perdas e ganhos de sequências de DNA do genoma inteiro20.
Outros autores8,13 também estudando culturas de vilosidades coriônicas, encontraram uma taxa de 4% (16 em 380) a 4,2% (12 em 287) de tetraploidia. Em nosso estudo os casos de monossomia do X representaram 20% (2 em 10) das anomalias cromossômicas encontradas, sendo semelhante a alguns estudos7,19,21 cujas taxas encontradas foram de 21,4% (6 em 28); 23,7% (68 em 287) e 25% (75 em 305), respectivamente. Já o estudo de Moraes et al. (2005) mostrou uma taxa significativamente diferente, 4,2% (4 em 95). Os estudos que mais apresentam semelhança com a nossa taxa de triploidia (10%; 1 em 10) são de Alberman e Creasy (1977), cuja taxa foi de 13,2% (38 em 287) e de Perrone, Silva e Cintra (2006), o qual apresenta uma taxa de 15,5% (11 em 71). Com relação ao caso de monossomia de um cromossomo autossomo do grupo D, na literatura não há relato de caso semelhante. Os cromossomos pertencentes a este grupo são os pares de acrocêntricos 13, 14 e 15. O embrião formado pode ter sido originado por um gameta monossômico, devido a uma não disjunção cromossômica envolvendo o cromossomo D durante a gametogênese materna ou paterna.22 Devido à qualidade do material, não foi possível identificar a qual par ele pertencia, mesmo analisando mais de dez metáfases.
Embora a técnica de citogenética seja empregada como conduta principal para triar e identificar as anomalias cromossômicas presentes na maioria dos abortos espontâneos de primeiro trimestre, o ideal é o uso combinado com tecnologias mais modernas, como FISH, Multiplex Ligation-dependent Probe Amplification (MLPA) ou aCGH, para melhor compreensão e diagnóstico mais preciso nesses casos.23
Apesar da amostra analisada ter sido pequena, foi possível observar que mais da metade dos casos de aborto espontâneo da nossa casuística foram causados por anomalias cromossômicas fetais.
Diversos estudos4,6,24,25 apontam a importância do estudo citogenético dos restos ovulares e sugerem que antes de os ginecologistas submeterem um casal que teve abortos a uma série de exames complementares sofisticados para investigar possíveis causas de perdas, seria fundamental analisar o cariótipo dos abortos em questão.
Conclusão
No nosso estudo encontramos dez cariótipos anormais e a frequência das anomalias cromossômicas foi determinada. Dentre elas encontramos trissomias, tetraploidia, triploidia, monossomia do X e monossomia de autossomo. As anomalias cromossômicas foram responsáveis por número elevado de abortos espontâneos comparado a literatura. O diagnóstico citogenético nestes casos auxilia o entendimento da perda fetal e ajuda tanto casais como médicos para que o aconselhamento genético seja mais completo e esclarecedor.
Não houve conflitos de interesses no presente estudo.
Agradecimentos
Nossos agradecimentos especiais as pacientes que aceitaram participar da pesquisa, aos funcionários da Maternidade Pró-Matre pela colaboração e parceria, aos funcionários do Serviço de Aconselhamento Genético da UFES e a todos que direta ou indiretamente colaboraram com este estudo.
Referências
1 Yakut S, Toru HS, Cetin Z, Özel D, Simsek M, Mendilcioğlu I, et al. Chromosome abnormalities identified in 457 spontaneous abortions and their histopathological findings. Turk Patoloji Derg. 2015;31(2):111-8.
2 Dhillon RK, Hillman SC, Morris RK, McMullan D, Williams D, Coomarasamy A, et al. Additional information from chromosomal microarray analysis (CMA) over conventional karyotyping when diagnosing chromosomal abnormalities in miscarriage: a systematic review and meta-analysis. BJOG. 2014;121(1):11-21.
3 Rabiega-Gmyrek D, Olejniczak T, Niepsuj-Biniás J, Guglas-Bochyńska B, Jachowski P, Latos-Bieleńska A, et al. Chromosomal aberrations – the cause of spontaneous abortions. Ginekol Pol. 2015;86(5):357-61.
4 Moraes AC, Moron AF, Hashimoto EM, Silva IDCG, Torloni MR, Souza MM, et al. Abordagem citogenética e molecular em material de abortos espontâneos. Rev Bras Ginecol Obstet. 2005;27(9):554-60.
5 Thompson MW, McInnes RR, Willard HF. Genética Médica. 5th ed. Rio de Janeiro: Guanabara Koogan, 1993. p.138-42.
6 Worton RG. Chromosome abnormalities: a major cause of birth defects, stillbirth and spontaneous abortion. Can Med Assoc J. 1977;117(8):849-51.
7 Uchida IA, Freeman VC, Gedeon M, Goldmaker J. Twinning rate in spontaneous abortions. Am J Hum Genet. 1983;35(5):987-93.
8 Alberman ED, Creasy MR. Frequency of chromosomal abnormalities in miscarriages and perinatal deaths. J Med Genet. 1977;14(5):313-5.
9 Procter SE, Watt JL, Gray ES. Cytogenetic analysis in 100 spontaneous abortions in North-East Scotland. Clin Genet. 1986;29(2):101-3.
10 Choi TY, Lee HM, Park WK, Jeong SY, Moon HS. Spontaneous abortion and recurrent miscarriage: A comparison of cytogenetic diagnosis in 250 cases. Obstet Gynecol Sci. 2014;57(6):518-25.
11 Horovitz DDG, Llerena Júnior JC, Mattos RA. Atenção aos defeitos congênitos no Brasil: panorama atual. Cad. Saúde Pública [online], Rio de Janeiro, BR,. 2005;21(4):1055-64.
12 GENOMA®. Laboratório de Genética do Espírito Santo. Cultura de vilo corial. Vitória, 2006.
13 Eiben B, Bartels I, Bähr-Porsch S, Borgmann S, Gatz G, Gellert G, et al. Cytogenetic analysis of 750 spontaneous abortions with the direct-preparation method of chorionic villi and its implications for studying genetic causes of pregnancy wastage. Am J Hum Genet. 1990;47(4):656-63.
14 Maluf SW, Félix TM, Schwartz IVD, Riegel M. Citogenética Humana. Porto Alegre: Artmed;2011. p.70-9.
15 Schinzel A. How human chromosome aberrations are formed. Atlas of Genetics and Cytogenetics in Oncology and Haematology. Poitier, France: Jean-Loup Huret, genetics DIM, University Hospital, 2007.
16 Sheppard DM, Fisher RA, Lawler SD, Povey S. Tetraploid conceptus with three paternal contributions. Hum Genet. 1982;62(4):371-4.
17 Surti U, Szulman AE, Wagner K, Leppert M, O’Brien SJ. Tetraploid partial hydatidiform moles: two cases with a triple paternal contribution and a 92,XXXY karyotype. Hum Genet. 1986;72(1):15-21.
18 Perrone DA, Silva DOM, Cintra TS. Frequência de Anomalias Cromossômicas em Abortos Espontâneos no Espírito Santo. Sogoes Revista. 2006;25:6.
19 Wei P, Li Y, Chen C, Zeng L, Qin S, Wang X, et al. Detection of chromosomal aneuploidies in spontaneous abortion samples by fluorescence in situ hybridization. Zhonghua Yi Xue Yi Chuan Xue Za Zhi. 2015;32(2):229-32.
20 Li Y, Gong Y, Liu H, Song Y, He W, Wei J, et al. Detection for chromosomal aberrations in 43 fetuses with spontaneous abortion and stillbirth by array-based comparative genomic hybridization. Zhonghua Yi Xue Yi Chuan Xue Za Zhi. 2015;32(3):348-52.
21 Kalousek DK. Anatomic and chromosome anomalies in specimens of early spontaneous abortions: seven-year experience. Birth Defects Orig Artic Ser. 1987; 23(1):153-68.
22 Hassold T, Hunt P. To err (meiotically) is human: the genesis of human aneuploidy. Nat Rev Genet. 2001;2(4):280-91.
23 Pinkel D, Straume T, Gray JW. Cytogenetic analysis using quantitative, high-sensitivity, fluorescence hybridization. Proc Natl Acad Sci U S A. 1986;83(9):2934-8.
24 Qumsiyeh MB. Chromosome abnormalities in the placenta and spontaneous abortions. J Matern Fetal Med.1998;7(4):210-2.
25 Hume H, Chasen ST. Trends in timing of prenatal diagnosis and abortion for fetal chromosomal abnormalities. Am J Obstet Gynecol. 2015;213(4):545.e1-4.
Anexos
Autores
Larissa Silva Zane¹*; Angela Maria Spagnol Perrone2; Iara Almeida Pinto3; Josivany Valério de Freitas Costa4; Marcela Souza Lima Paulo5; Agatha Cristhina Oliveira Faria6; Flavia Imbroisi Valle Errera7; Maria Regina Galvêas Oliveira Rebouças8
1 Bióloga – Mestranda em Biotecnologia (UFES), bolsista FAPES.
2 Especialização em citogenetica, Bióloga (Laboratório Genoma do Espírito Santo).
3 Farmacêutica pela Escola Superior de Ciência da Santa Casa de Misericórdia de Vitória –EMESCAM, Bolsista CNPq.
4 Bióloga – Doutoranda na Rede Nordeste de Biotecnologia – RENORBIO – Universidade Federal do Espirito Santo – UFES.
5 Doutora pela Universidade Federal de Minas Gerais – UFMG, Bióloga, Professora de Medicina, Ciência e Tecnologia (EMESCAM)
6 Farmacêutica – Doutoranda em ciências – Genética (USP)
7 Doutora em Ciências – Genética (USP), Bióloga – Professora de Genética, Biologia Molecular (EMESCAM).
8 Mestre em Ciências – Genética (USP), Médica Geneticista do HINSG e Professora de Genética (UVV).
Artigo recebido em 25 de março de 2015
Artigo aprovado em 17 de novembro 2015