EFEITOS AGUDOS E CRÔNICOS DO CHUMBO SOBRE VASOS DE CONDUTÂNCIA
Resumo
Neste estudo objetiva-se demonstrar os principais efeitos da exposição ao chumbo sobre sistema vascular enfatizando os vasos de condutância. Para isso foi realizada uma revisão narrativa tendo dois eixos principais: 1) pergunta norteadora: Quais os efeitos da exposição aguda e crônica ao chumbo sobre os vasos de condutância em humanos e em animais experimentais: 2) revisão da literatura e seleção dos estudos pertinentes a este tema. Os estudos apresentados nessa revisão evidenciaram que o chumbo, independente do tempo de exposição, promove alterações vasculares que se associam diretamente com aumento da pressão arterial contribuindo para desenvolvimento de hipertensão arterial. Outro aspecto importante, é que em todos os trabalhos que realizaram a análise sanguínea após exposição ao chumbo, foram encontrados valores bem abaixo daqueles preconizados como seguros pelas agências de toxicovigilância do Brasil e de outros países. As pesquisas realizadas, tanto em humanos quanto em animais experimentais, apontam o chumbo como importante fator de risco para desenvolvimento de doenças cardiovasculares, sendo necessário reduzir os níveis de exposição preconizados como seguros na população geral.
Introdução
O chumbo, a partir da sua alta toxicidade é capaz de promover efeitos adversos no organismo humano. Esse metal é estocado no tecido ósseo e promove alterações sobre o mesmo1 e pode ainda ser armazenado em tecidos moles como: rins; glândulas suprarrenais; pâncreas; vesícula biliar; ovários; próstata; testículos, coração, vasos sanguíneos e músculo esquelético. As concentrações desse cátion nesses tecidos parecem ser constantes ao longo da vida, devido a sua alta taxa de rotatividade.2 Os efeitos tóxicos do chumbo são potencializados por alguns fatores como a idade, fatores nutricionais pela deficiência de ferro e desnutrição e pela presença de doenças concomitantes.3
A exposição ao chumbo é amplamente reconhecida como um problema comum de saúde ocupacional e ambiental.4 Estudos clínicos e epidemiológicos mostram uma correlação entre a concentração de chumbo no sangue e a pressão arterial. Isso ocorre mesmo em baixas concentrações, como por exemplo, 10 a 25 µg/dL de Pb-S,5 semelhantes aos valores observados em uma população exposta ambientalmente a esse metal.6-8 Os efeitos maléficos desse metal sobre o sistema cardiovascular cursam com o desenvolvimento de doenças que comprometem esse sistema como, por exemplo, alterações na pressão arterial,8,9 doença arterial coronariana, infarto do miocárdio e doença arterial periférica. 9,10
De acordo com a Organização Mundial de Saúde, as doenças cardiovasculares são, atualmente, a principal causa de mortalidade e morbidade no mundo11 e a exposição a agentes tóxicos, incluindo o chumbo e outros metais, pode contribuir para o surgimento ou agravo desses processos patológicos. Os estudos populacionais acerca dos efeitos cardiovasculares do chumbo estão focados na associação entre sua exposição e o desenvolvimento de hipertensão arterial. Por outro lado, pesquisas realizadas em animais experimentais procuram elucidar, além do efeito hipertensor, os mecanismos envolvidos nas alterações cardiovasculares promovidas por esse metal.9
Cumpre ressaltar que ao analisar os efeitos do chumbo sobre o sistema vascular deve ser considerado o tipo de leito estudado (resistência ou de condutância). Além disso, outros fatores como: a dose, o tempo e a via de exposição ao metal devem ser observados, já que todos eles influenciam de forma diferente nos resultados provocados por esse cátion nos organismos biológicos.
Nesta revisão serão enfatizados os efeitos tóxicos do chumbo, sobre os vasos de condutância, especialmente a artéria aorta. Serão apresentados estudos realizados em humanos e em animais experimentais que demonstraram a relação entre exposição aguda e crônica a esse metal com as doenças vasculares.
– Efeitos vasculares agudos e crônicos do chumbo em humanos e em animais experimentais
Furchgott & Vanhoutte12 descreveram pela primeira vez o papel do endotélio na regulação do tônus vascular. A partir desse estudo, os vasos sanguíneos não são mais vistos apenas como condutores de humores no sistema circulatório. Atualmente, sabe-se que o endotélio é capaz de liberar substâncias metabolicamente ativas, as quais modulam importantes funções no organismo tais como o controle do tônus vasomotor, o calibre vascular, o fluxo sanguíneo, e também participa do controle das respostas inflamatórias e imunológicas.12,13 De fato, as funções do sistema vascular implicam complexas interações entre endotélio, músculo liso vascular, sistema imunológico, sistema nervoso. Além disso, essas ligações estão presentes nos processos químicos e metabólicos de órgãos individuais.14-17
Neste sentido, diversos trabalhos têm apontado que a toxicidade dos metais pesados (chumbo, mercúrio, cádmio, cobre, arsênio) tem como alvo de ataque o sistema vascular, promovendo danos que variam desde lesões hemorrágicas a outros processos patológicos incluindo edema, aterosclerose e hipertensão arterial. Além disso, os efeitos vasculares desses elementos podem atuar em órgãos específicos prejudicando os processos metabólicos e de remodelamento celular.18-22
Diversos mecanismos têm sido propostos para explicar a gênese da hipertensão arterial causada pelo chumbo envolvendo, principalmente, interações desse metal com processos regulatórios endógenos presentes nas células endoteliais e do músculo liso vascular. Entre esses fatores destacam-se: inibição da Na+/K+-ATPase; aumento da atividade do sistema renina-angiotensina;23-27 disfunção endotelial;27-29 e do músculo liso vascular.30-36
Nas últimas décadas, as pesquisas relacionadas com o chumbo têm focado em seus efeitos diretos e/ou indiretos sobre a estrutura vascular. Isso foi observado tanto nos estudos realizados em humanos quanto em animais experimentais. Contudo, ainda não existe consenso entre os autores quanto às vias de ação do chumbo no organismo biológico.
Barbosa Jr. et al,4 estudaram 62 voluntários residentes na cidade de Bauru (SP- Brasil) que foram expostos ambientalmente ao chumbo. Esses autores demonstraram uma correlação negativa entre o nitrito plasmático e o chumbo presente no plasma e no sangue desses voluntários, sugerindo que esse metal promove efeito inibitório na formação do óxido nítrico (NO). Esse achado é suportado por outros estudos cujos resultados evidenciaram que mensurações da concentração de nitrito plasmático refletem a atividade da enzima óxido nítrico sintase (NOS).37-39 DenHond, et al,40 utilizando dados do ThirdNational Health andNutrition Examination Survey (NHANES III), observaram correlação positiva entre a concentração de chumbo e a pressão arterial aumentada em mulheres e homens negros.
Além disso, evidências apontam o envolvimento natural do envenenamento agudo e crônico por chumbo, promovendo doenças cardíacas como: miocardites;42 alterações eletrocardiográficas; alteração na frequência cardíaca e degeneração vascular; diminuição da sístole ventricular.41,42
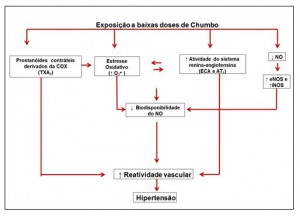
Em uma série de estudos realizados no nosso laboratório, demonstramos que a exposição aguda e crônica ao chumbo aumenta a pressão arterial de ratos associada com disfunções vasculares. Foram evidenciados nesses estudos repostas diferenciadas dependentes do tempo e via de exposição ao chumbo. Silveira et al,43 verificaram os efeitos agudos do chumbo no leito caudal de ratos expostos agudamente a altas concentrações de chumbo (100 μΜ). Os achados desse estudo revelam aumento na reatividade das artérias caudais à fenilefrina (agonista α1-adrenérgico). Essa resposta foi dependente do endotélio e as alterações funcionais observadas nessas artérias sugerem o envolvimento local das seguintes vias: óxido nítrico; ciclooxigenase e espécies reativas de oxigênio. Os principais achados desse estudo podem ser verificados no esquema (1) abaixo.
Esquema1: Representando as vias endoteliais envolvidas no efeito do chumbo sobre a artéria aorta de ratos expostos a baixas doses de acetato de chumbo (Silveira et al., 2010).
Em outros trabalhos realizados no nosso laboratório,26,44 os animais foram expostos por 7 dias a baixas doses (via injeções intramuscular) de chumbo. Após esse períodoa foi observado nos animais expostos uma concentração sanguínea de chumbo de 9,98 ± 1,70 µg/dL. As análises funcionais e bioquímicas desses estudos evidenciaram redução da resposta contrátil à fenilefrina e maior biodisponibilidade do NO em anéis de aorta.44 Os estudos também verificaram aumento na produção de radicais livres, ativação dos canais para potássio e aumento da atividade da Na+/K+ATPase.26 Os autores desses estudos sugerem que o aumento do NO e a ativação dos canais de potássio e da bomba de sódio podem reduzir o tônus vascular nos estágios iniciais de exposição ao chumbo, contrapondo às ações vasoconstritoras dos radicais livres.
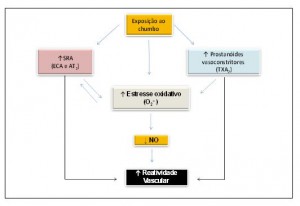
Por outro lado, Silveira et al.27 estudaram os efeitos do chumbo 30 dias após a exposição diária (injeções intramuscular) a baixas doses desse metal. Após esse período, os ratos expostos apresentaram uma concentração sanguínea de 12 ± 1,34 µg/dL. Nesse estudo foi verificado aumento na pressão arterial sistólica associada às alterações funcionais e bioquímicas analisadas em anéis de aorta dos animais experimentais. Esses autores propõem que o aumento na reatividade vascular pode ser atribuído à redução na biodisponibilidade do NO causada pelo aumento da produção das espécies reativas de oxigênio via NAD(P)H oxidase, e também à menor modulação endotelial negativa, envolvendo maior participação do ânion superóxido, dos prostanoides contráteis derivados da COX, especialmente o TXA2 e participação do sistema renina-angiotensina nesta resposta. Os resultados funcionais desse estudo se confirmaram em alguns achados bioquímicos que revelaram incremento na expressão proteica das isoformaseNOS e iNOS e no receptor AT1. Os principais resultados desse estudo encontram-se sumarizados no esquema (2) abaixo.
Esquema 2: Representação das vias endoteliais envolvidas no efeito do chumbo sobre a artéria aorta de ratos (Silveira et al., 2014).
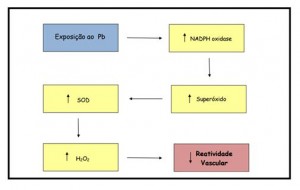
Por fim, Nunes et al,45 investigaram os efeitos do chumbo sobre a reatividade vascular de artérias aortas de ratos, após 30 dias de exposição diária a 100 ppm de chumbo na água de beber. A concentração sanguínea dos animais expostos ao chumbo foi de 8,4 µg/dL ± 1,1 µg/dL. Os achados dessa pesquisa revelaram aumento na produção de ânion superóxido (O2.-) pela NAD(P)H oxidase desencadeando um aumento compensatório da atividade da enzima superóxido dismutase (SOD). Segundo os autores, o aumento da atividade dessa enzima elevou a produção de peróxido de hidrogênio (H2O2) que foi o responsável pela diminuição da reatividade vascular. A figura 3 ilustra os principais achados desse estudo.
Figura 3: Representação das principais vias endoteliais em anéis de aorta após 30 dias exposição a 100 ppm de acetato de chumbo na água de beber (Nunes et al., 2015).
Analisando os principais achados encontrados nas pesquisas de Silveira et al,27,43 Fiorimet al,26,44 e Nunes et al,45 observa-se que os efeitos deletérios do chumbo na reatividade vascular de vasos de condutância são dependentes do tempo de exposição e também da via de exposição. Essa diferença está claramente demonstrada nos resultados que evidenciaram aumento27,44 e redução da reatividade vascular.26,44, 45
Conclusão
Diante dos estudos apresentados nessa revisão, é possível verificar que o chumbo de fato promove alterações vasculares que cursam com aumento da pressão arterial. Cumpre destacar que essas alterações estão presentes em estudos realizados tanto em humanos quanto em animais experimentais. Sabe-se que as doenças cardiovasculares representam uma das principais causas de morte e morbidade no Brasil e em outros países. Sendo assim, ratificamos a necessidade de se fazer um alerta às agências de toxicovigilância quanto aos níveis de exposição ao chumbo, considerados seguros para os indivíduos expostos à contaminação ocupacional e ambiental a esse metal. Além disso, é importante incluir o chumbo como fator de risco para o desenvolvimento de várias doenças cardiovasculares.
Referências
- Smith AH; Sciortino S; Goeden H; Wright CC. Consideration of background exposure in the management of hazardous waste sites: A New Approach to Rick Assessment. Risk Analysis. 1996;16(5):619-625.
- Barry, PS. A comparison of concentrations of lead in human tissues. Br J Ind Med. 1975;32:119-139.
- Keogh JP; Boyer LV. Lead – Specific Health Hazards and Toxins. In_: Clinical Environmental Health and Toxic Exposures. Sullivan, J.B. and Krieger, G.R. (eds). 2001. Williams & WilKins, Philadelphia, USA.
- Barbosa FJr; Tanus-Santos, JE; Gerlach RF; Parsons, PJ. A Critical Review of Biomarkers Used for Monitoring Human Exposure to Lead: Advantages, Limitations, and Future Needs. Environtal Health Persp. 2005;13:1669-74.
- Wedeen RP. Bone Lead, Hypertension, and Lead Nephropathy. Environtal Health Persp. 1988;78:57-60.
- Beevers DG, Erskine E, Robertson M, Beattie AD, Campbell BC, Goldberg A, Moore MR, Hawthorne VM. Blood-lead and hypertension. 1976;2:1-3.
- Harlan, WR; Landis, JR; Schmouder, RL; Goldstein, NG; Harlan, LC. Blood lead and blood pressure. Relationship in the adolescent and adult US population. JAMA. 1985;253:530-534.
- Schwartz J.The Relationship Between Blood Lead and Blood Pressure in the NHANES II Survey. Environtal Health Persp. 1988;78:15-22.
- Navas-Acien A, Guallar E, Silbergeld EK, Rothenberg SJ. Lead exposure and cardiovascular disease a systematic review. Environ Health Perspect. 2007;115:472-482.
- Menke A; Muntner P; Batuman V; Silbergeld EK; Guallar E. Blood lead below 0.48 micromol/L (10 microg/dL) and mortality among US adults. 2006;114(13):1388-94.
- World Health Organization (WHO) (2011) Cardiovascular Diseases. Available: http://www.who.int/cardiovasculardiseases/en/.
- Furchgott, RF; Zawadzki, JV. The obligatory role of endothelial cells in the relaxation of arterial smooth muscle by acetylcoline. Nature. 1980;288:373-376.
- Rubanyi GM. The role of endothelium in cardiovascular homeostasis and diseases. J Cardiovasc Pharmacol. 1993;22 Suppl 4: S1-14.
- Galley HF, Webster NR. Physiology of the endothelium. Br J Anaesth. 2004;93(1):105-13.
- Gibbins IL, Jobling P, Morris JL. Functional organization of peripheral vasomotor pathways. Acta PhysiolScand. 2003;177(3):237-45.
- Hill MD, Silver FL. Epidemiologic predictors of 30-daysurvival in cerebellar hemorrhage. J Stroke Cerebrovasc Dis. 2001;10(3):118-21.
- Villar IC, Francis S, Webb A, Hobbs AJ, Ahluwalia A. Novel aspects of endothelium-dependent regulation of vascular tone. Kidney Int. 2006;70(5):840-53.
- Navas-Acien A, Sharrett AR, Silbergeld EK, Schwartz BS, Nachman KE, Burke TA, Guallar E. Arsenic exposure and cardiovascular disease: a systematic review of the epidemiologic evidence. Am J Epidemiol. 2005;162(11):1037-49.
- Prozialeck WC, Edwards JR, Woods JM. The vascular endothelium as a target of cadmium toxicity. Life Sci. 2006;79(16):1493-506.
- Liu F; Inageda K; Nishitai G; Matsuoka M. Cadmium Induces the Expression of Grp78, an endoplasmic reticulum molecular chaperone, in LLC-PK1 renal epithelial cells. Environ Health Perspect. 2006;114(6):859-64.
- Vassallo DV; Simões MR; Furieri LB; Fioresi M; Fiorim J; Silveria EA; et al. Toxic effects of mercury, lead and gadoliniumon vascular reactivity. Braz J Med Biol Res. 2011;44:939-946.
- Liu K; Gu P; Chen W; Shi J; Xia L. Effect of Pregnancy on the Levels of Blood Cadmium and Lead: analysis of 2006-2011 Nanjing Maternity and Child Health Care Hospital Survey Data. Iranian J Publ Health. 2013;42(7):691-699.
- Weiler E, Khalil-Manesh F; Gonick H. Effects of Lead and Natriuretic Hormone on Kinetics of Sodium-Potassium Activated AdenosineTriphosphatase: Possible Relevance to Hypertension. Environ Health Perspect. 1988;78:113-115.
- Sharifi, MA; Darabi, R; Akbarloo, N; Larijani, B; Khoshbaten, A. Investigation of circulatory and tissue ACE activity during development of lead-induced hypertension. Toxicol Lett. 2004;153:233-238.
- Simões MR, Ribeiro Júnior RF, Vescovi MV, de Jesus HC, Padilha AS, Stefanon I, et al. M. Acute lead exposure increases arterial pressure: role of the Renin-Angiotensin system. PloSOne. 2011;6(4):e18730.
- Fiorim J, Ribeiro Júnior RF, Azevedo BF, Simões BMR, Padilha AS, Stefanon I, et al. DV. Activation of K+ channels and Na+/K+ATPase prevents aortic endothelial dysfunction in 7-day lead-treated rats.Toxicol Appl Pharm. 2012;262:22-31.
- Silveira EA, Siman FD, de Oliveira Faria T, Vescovi MV, Furieri LB, Lizardo JH, et al. Low-dose chronic lead exposure increases systolic arterial pressure and vascular reactivity of rat aortas. Free Radic Biol Med. 2014; 67: 366-76.
- Vaziri, ND; Liang, K; Ding, Y. Increased nitric oxide inactivation by reactive oxygen species in lead-induced hypertension. Kidney Int. 1999;56:1492-98.
- Vaziri, ND. Mechanismsof lead-inducedhypertensionand cardiovascular disease.Am J Physiol Heart Circ Physiol.2008; 295:H454–H465.
- Webb RC, Winquist RJ, Victery W, Vander AJ. In vivo and in vitro effects of lead on vascular reactivity in rats. Am J Physiol.1981;241: H211-H216.
- Tomera, JF, Harakal C. Mercury and lead-induced contraction of aortic smooth muscle in vitro. Arch Int Pharmacodyn Ther. 1986;283: 295-302.
- Chai S, Webb RC. Effects of lead on vascular reactivity. Environtal Health Persp. 1988;78:85-89.
- Watts SW, Chai S, Webb RC. Lead acetate-inducedcontraction in rabbitmesentericartery: interaction with calcium and protein kinase C. Toxicol. 1995;99(1-2):55-65.
- Fujiwara Y, Kaji T, Yamamoto C, Sakamoto M, Kozuka H. Stimulatory effect of lead on the proliferation of cultured vascular smooth-muscle cells. Toxicol. 1995;98(1-3):105-10.
- Kaji T, Fujiwara Y, Hoshino M, Yamamoto C, Sakamoto M, Kozuka H. Inhibitory effect of lead on the proliferation of cultured vascular endotelial cells. Toxicol. 1995;95(1-3):87-92.
- Marques M, Millás I, Jiménez A, García-Colis E, Rodriguez-Feo JA, Velasco S; et al. Alteration of the soluble guanylate cyclase system in the vascular wall of lead-induced hypertension in rats. J Am Soc Nephrol. 2001;12:2594–600
- Kelm M, Preik-Steinhoff H, Preik M, Strauer BE. Serum nitrite sensitively reflects endothelial NO formation in human forearm vasculature: evidence for biochemical assess ment of the endothelial L-arginine–NO pathway. Cardiovasc Res. 1999; 41:765-772.
- Lauer T, Preik M, Rassaf T, Strauer BE, Feelisch ADM, Kelm M. Plasma nitrite rather than nitrate reflects regional endothelial nitric oxide synthase activity but lacks intrinsic vasodilator action. 2001;98(22):12814–819.
- Kleinbongard P, Dejam A, Lauer T, Jax T, Kerber S, Gharini P, et al. Plasma nitrite concentrations reflect the degree of endothelial dysfunction in humans. Free Radic Biol Med. 2006;40(2):295-302.
- DenHond E; Nawrot T; Staessen JA. The relationship between blood pressure and blood lead in NHANES III National Health and Nutritio Examination Survey. J Hum Hypertens. 2002;16:563-568.
- Read JL, Williams JP. Lead myocarditis: Report of a case. Am J Heart.1952;44:797-802.
- Stöfen D. Environmental lead and the heart. J Mol Cell Cardiol. 1974;6:285-90.
- Dimitrova, M. Changes in the contractile function of the myocardium in chronic saturnism. Arch Mal Prof. 1972;33(7):383-8.
- Silveira, EA; Lizardo, JH; Souza, LP; Stefanon, I; Vassallo, DV. Acute lead-induced vasoconstriction in the vascular beds of isolated perfused rat tails is endothelium dependent. Braz J Med Biol Res.2010;43(5):492-9.
- Fiorim J, Ribeiro Júnior RF, Silveira EA, Padilha AS, Vescovi MV; de Jesus HC, et al. Low-level lead exposure increases systolic arterial pressure and endothelium derived vasodilator factors in rat aortas. PLoSOne. 2011;6:e17117.
- Nunes ZK, Nunes DN, Silveira EA, Pereira CAC, Broseghini Filho GB, Vassallo VD, et al. Chronic lead exposure decreases the vascular reactivity of rat aortas: The Role of Hydrogen Peroxide. PLoSOne. 2015;10(3):e0120965.
Autores
Edna Aparecida Silveira1, Maylla Ronacher Simões2, Jonaína Fiorim3, Mirian Fioresi4
1,3 Doutora em Ciências Fisiológicas pelo PPGCF-UFES; Fisioterapeuta do Hospital Universitário Cassiano Antônio Moraes, HUCAM.
2Doutora em Ciências Fisiológicas pelo PPGCF-UFES; Pós-doutoranda do PPGCF-UFES.
4Doutora em Ciências Fisiológicas pelo Programa de Pós-Graduação em Ciências Fisiológicas da Universidade Federal do Espírito Santo, PPGCF-UFES; Professora do Departamento de Enfermagem, UFES, Brasil.